通过静电了解分子、指导新分子设计
在新分子设计中,视觉反馈可以帮您了解配体结合、结构-活性关系并对新分子设计进行排序。Flare使用XED力场来计算蛋白质活性位点和配体的静电特性。相互作用势为您提供有关配体-蛋白结合基础过程的重要知识,有助于您的新分子设计更加完美。
静电互补性(Electrostatic Complementarity,EC)
- 生成蛋白和配体的表面、计算静电互补 性(Electrostatic Complementarity,EC) 打分值并映射到蛋白表面,可以快速地进行活性预测。
- 以视觉和数值方式快速地评估蛋白结合位点和配体之间的静电互补性。
- 对于静电驱动的相互作用,了解EC打分与生物活性之间的相关性可以改进分子预测与设计。
- 计算成本低且易于在蛋白质家族中评估大型的配体数据集,以便搜索、比较、趋势分析和改进。
- 静电互补性是一种快速、有效的工具,可用于优化蛋白-配体复合物的结合与选择性(参见J. Med. Chem. 2019, 62(6):3036-3050)。
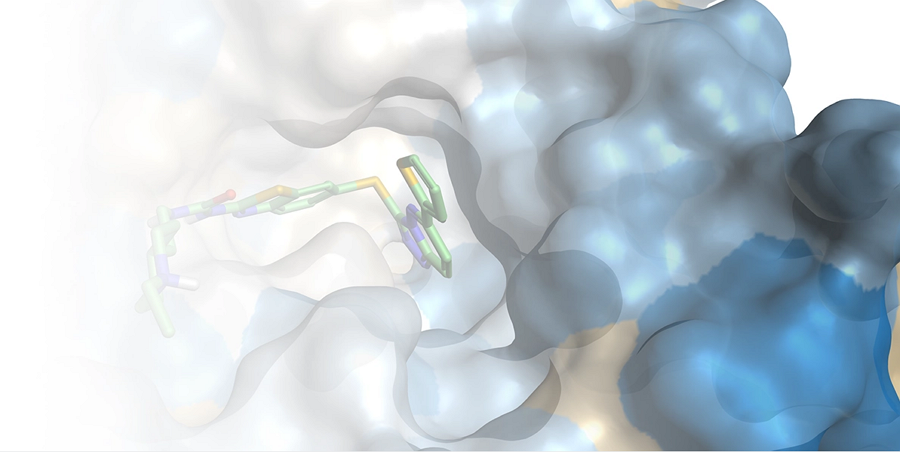
PDB 4UIV蛋白表面及其与共晶配体的静电互补性分析结果。绿色:蛋白-配体静电有利的区域(绿色),红色:静电具有改善空间的区域。
蛋白相互作用势(Protein interaction potentials,PIP)
- 蛋白相互作用势 (PIP) 也称为“蛋白质场” 是Cresset分子相互作用势的延伸,绘制配体蛋白相互作用相关的场。
- 确定放置配体原子的位置,识别静电有利的水位置。
- 使用这些表面分析工具来预测选择性、检查突变分析、帮助选择质子化和互变异构状态,并优化结合相互作用。
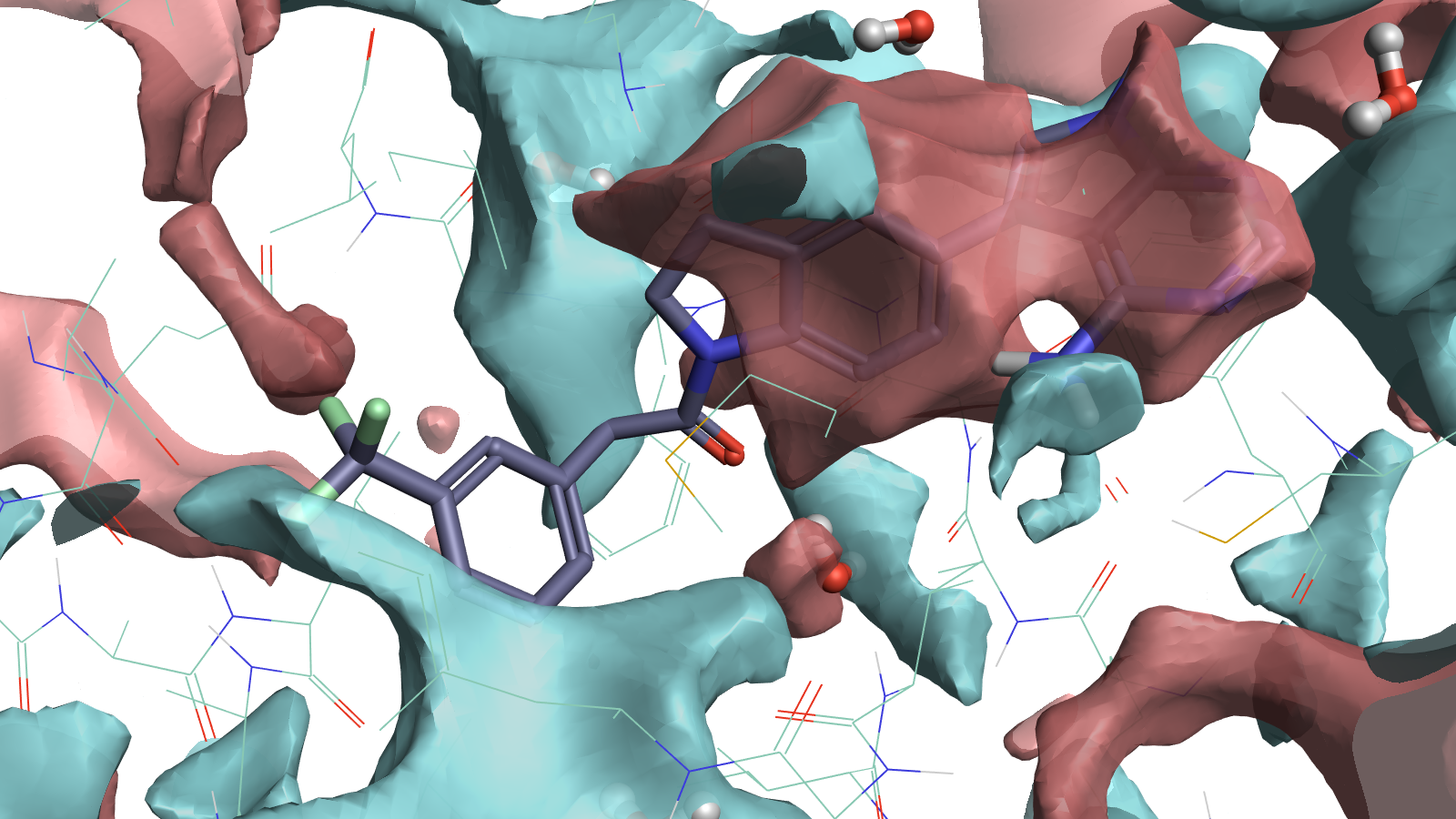
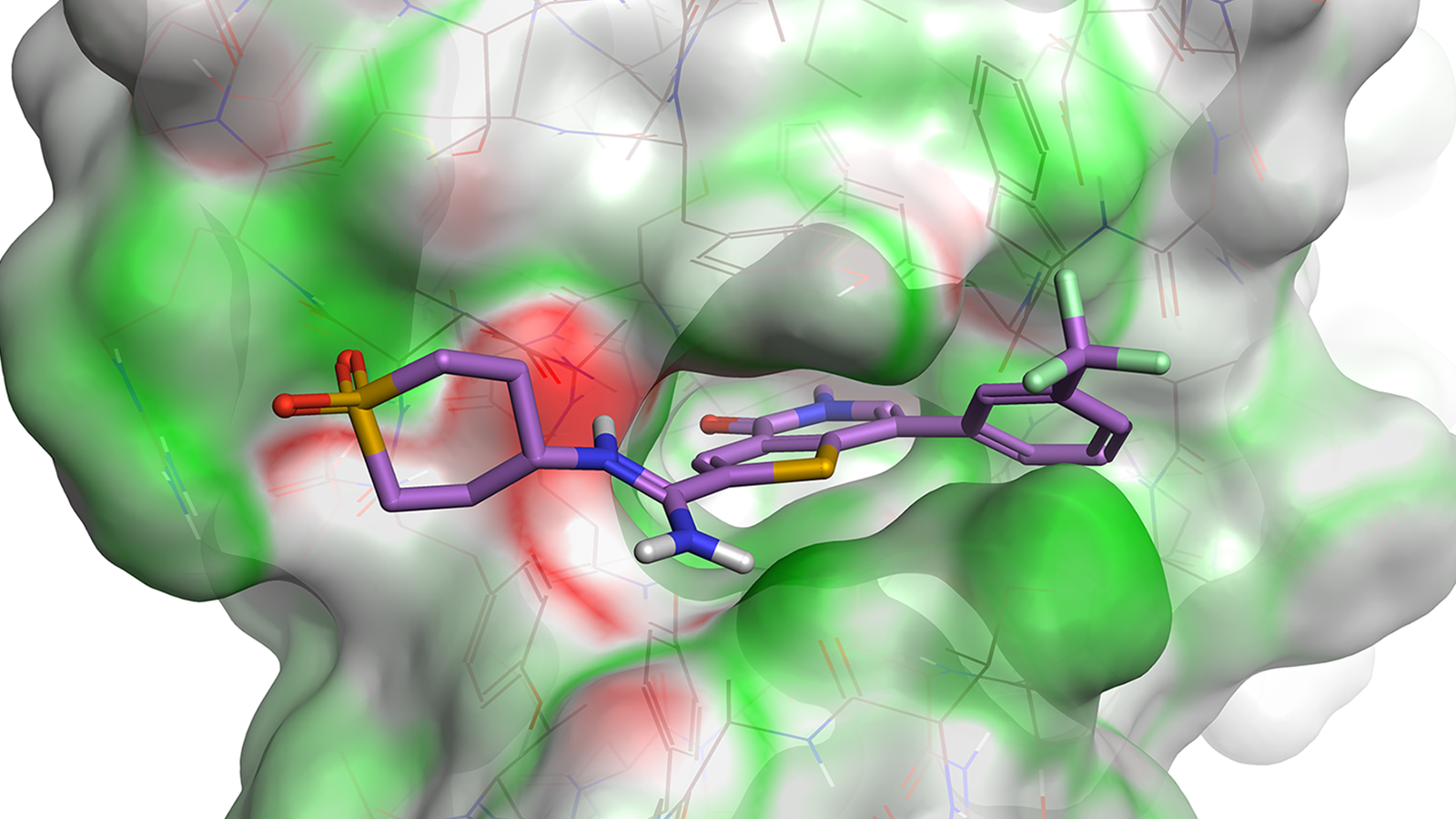
PDB 4G31完整的蛋白相互作用势映射图可以用来指导配体原子的放置。 负(蓝色)配体表面填充在正(红色)蛋白表面区域,这说明该位置的配体静电合适。静电有利的水位置也是可见的,表明您可以用配体上的极性相互作用来替换该位置上的水。
静电势表面(Electrostatic Potential surfaces,EPS)
- 相互作用场可以映射到蛋白质表面,从而可以快速轻松地目视评估跨蛋白质家族的静电趋势。
- 通过比较相关蛋白来确定选择性机会,使用蛋白静电特征更好地了解配体SAR。
PDB 4G31完整的蛋白相互作用势映射图可以用来指导配体原子的放置。 负(蓝色)配体表面填充在正(红色)蛋白表面区域,这说明该位置的配体静电合适。静电有利的水位置也是可见的,表明您可以用配体上的极性相互作用来替换该位置上的水。
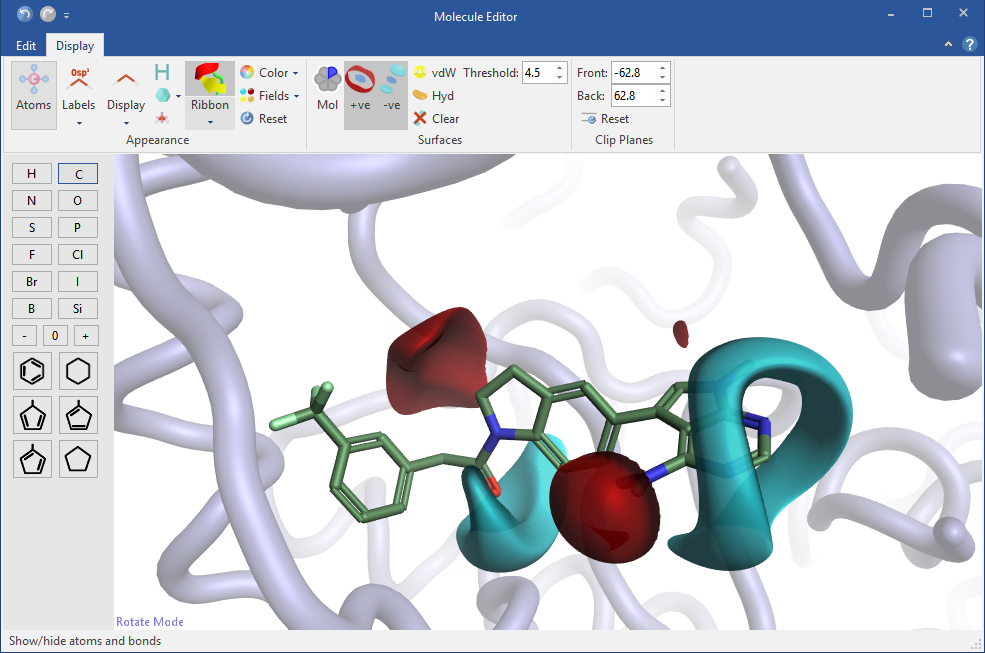
编辑新分子,实时了解静电变化
在Flare中设计新配体的时候,您可以在蛋白活性位点中实时观察分子的静电变化,获得反馈。
案例分析与相关主题
Flare™
进一步探索Flare如何为你的分子设计增加新的见解