原文
Hillig RC, Sautier B, Schroeder J, et al. Discovery of potent SOS1 inhibitors that block RAS activation via disruption of the RAS–SOS1 interaction. Proc Natl Acad Sci. 2019;116(7):2551-2560. doi:10.1073/pnas.1812963116
前言
拜尔公司最近发表了一篇关于高效、选择性SOS1抑制剂的文章,该抑制剂能够通过干扰RAS-SOS1相互作用而阻断RAS活化。在该文中,作者首先通过片段筛选与高通量筛选分别发现了片段分子F1与SOS1抑制剂化合物17。高通量筛选命中的化合物17结合于SOS1的主结合口袋(PDB:5OVF),而分子片段F1结合于主结合口袋旁边的子结合口袋(PDB:6EPM)。F1与化合物17有部分叠合,然后作者将两者的叠合部分删除,用Spark的分子连接策略进行了虚拟筛选,合理地设计了可以连接F1与化合物17的连接臂,最后发现了化合物BAY-293,是一种KRAS-SOS1相互作用的强效、选择性的抑制剂。我们对该文进行了综述,与大家分享该文的关键方法与结论。
基于片段的筛选
拜耳的科研人员决定采取双管齐下的方法:同时开展高通量筛选与和片段筛选。对一个含有3,000个片段的化合物库筛选出了与KRAS-SOS1蛋白-蛋白相互作用位点结合并可在该位点诱导构象变化的片段。其通过触发Phe890侧链的旋转,然后打开了与主结合口袋相邻的新子结合口袋。
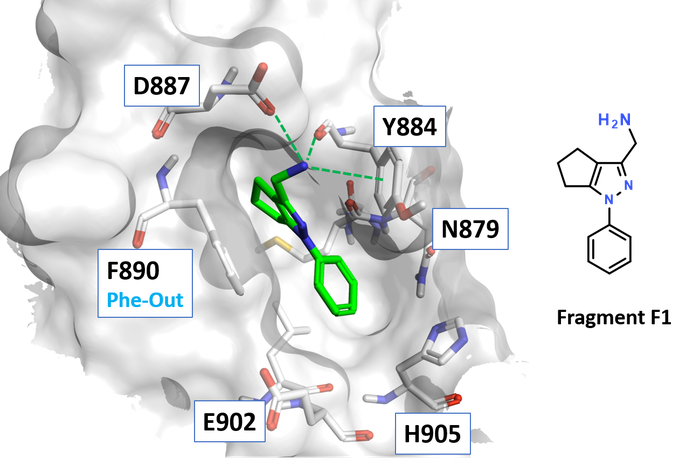
Figure 1. F1-SOS1复合物晶体结构(PDB: 6EPM)
片段F1被选作为进一步优化的起点。 F1与SOS1复合物晶体结构(pdb:6epm,图1)表明苯基部分与Phe890(Phe-out)发生 π-π 相互作用。氨甲基部分与Asp887和Tyr884的主链羰基形成氢键,并与Tyr884侧链形成额外的阳离子-π 相互作用。
高通量筛选与初步的优化
拜尔的科研人员还对一个含300万化合物的数据库进行了高通量筛选,结果发现了化合物1(IC50=320nM,Figure 2.)
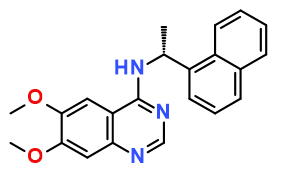
Figure 2. 化合物1(IC50=320nM)
用吡唑基苯基取代化合物1中的萘基部分得到化合物17(图3),显示出对SOS1的良好活性(IC50 = 140nM)和改善的水溶性。
化合物17与SOS1复合物晶体结构(pdb:5ovf,图3)解释了作用模式:化合物17的喹唑啉骨架夹在His905和Tyr884之间(π-π 堆叠)。吡唑基苯基部分占据了由Leu901和Phe890(Phe-in)组成的疏水口袋中,并与Tyr884的侧链有T-堆积相互作用。吡唑部分与Glu902形成水桥连的H-键。中心苯胺NH与Asn879的侧链形成H-键。
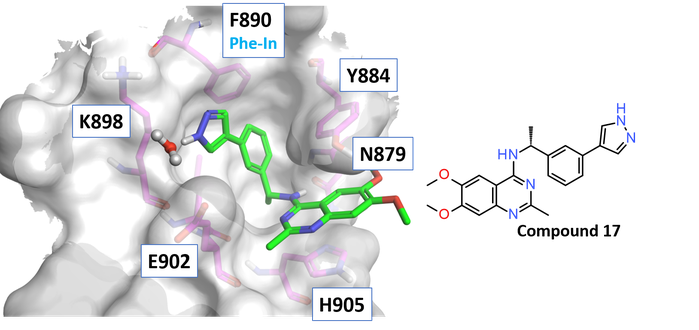
Figure 3: 化合物17与SOS1SB的复合物晶体结构(PDB:5OVF)
用SPARK的分子连接策略将片段F1与化合物17的连接起来
由于片段筛选识别了尚未被高通量命中化合物结合的新的子口袋,拜尔的科研人员尝试了使用Spark的配体连接方法:通过组合两种配体来进一步提高活性。如图4-A分析了化合物17(pdb:5ovf)和F1(pdb:6epm)晶体结构的叠加效果,表明这个策略是可行的。
将化合物17和F1叠合的芳基切除,作者用Spark进行了配体连接实验(图4-b,c)以确定合适的连接臂:使F1的四氢环戊[c]吡唑部分和17的氨基喹唑啉基团在SOS1的活性部位正确定位。在Spark给出的得分最高的连接臂中,噻吩连接臂被选中、合成、最后生物学测试发现是活性的。
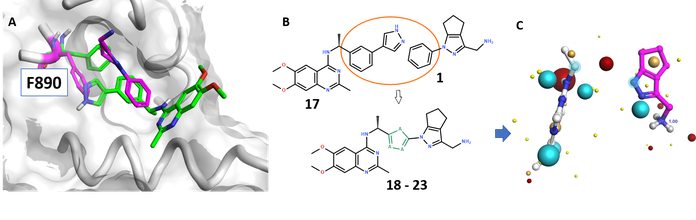
Figure 4: Ligand-joining approach of fragment and HTS hits. A) Superimposition of the crystal structures of F1 bound to KRASG12C_SB–SOS1cat (SOS1 in gray, F1 and Phe890 with carbon atoms in magenta) and 17 bound to SOS1SB (17 and Phe890 shown; carbon atoms in green). B) Schematic depiction of the merging approach. C): Representation of F1 and 17 with respective fields from Cresset.
视频演示:起始结构的准备
本视频包含了:SOS1与F1、化合物17复合物结构的下载;蛋白结构准备;序列比对、蛋白叠合、化合物导出保存为起始结构starter.sdf。
视频演示:分子连接、发现先导化合物
在本视频中,包含了:(1)读入上一步准备好的起始结构;(2)准备连接点;(3)虚拟筛选。其中第一轮仅对对非常常见的片段库进行筛选,仅命中两个化合物。因此又进行了第二轮筛选,发现了文献报道的噻吩骨架:不同位置的取代基均被命中, 见Figure 5。
SPARK虚拟筛选命中的部分化合物如图5所示。其中左上角化合物为两个起始的分子;另外三个化合物为命中的化合物。
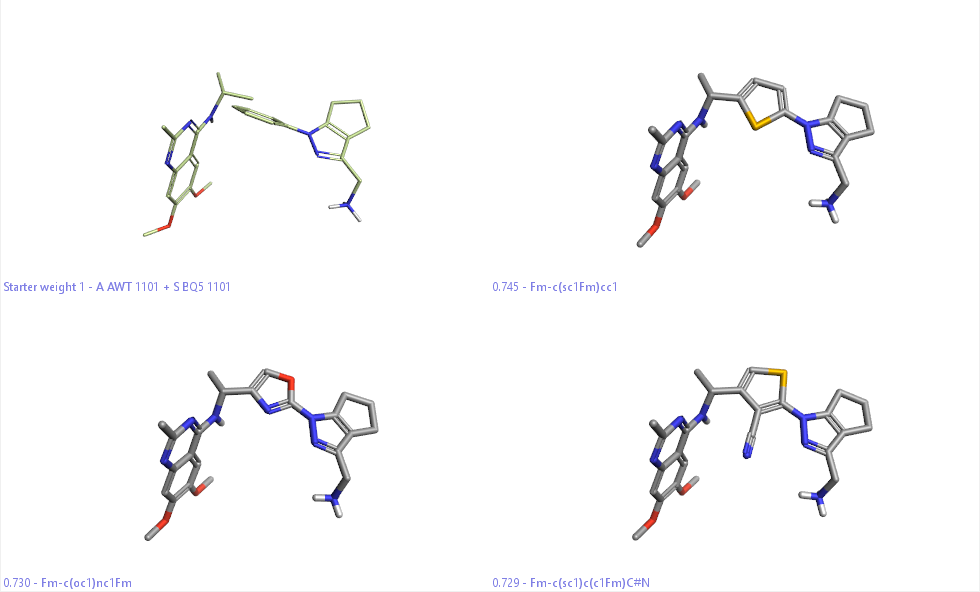
Figure 5.SPARK虚拟筛选结果示例。
进一步优化发现BAY-293
对噻吩连接臂杂交出的苗头化合物引入模拟F1片段与氨基侧链氢键相互作用的极性部分(如OH,NH2)可以触发Phe-out构象,导致发现了活性优化的化合物23(BAY-293,IC50=21nM)。 如图6所示,化合物23的侧链氨基通过与Asp887和Tyr884主链羰基形成H-键相互作用以及与Tyr884侧链的阳离子-π相互作用与SOS1相互作用。
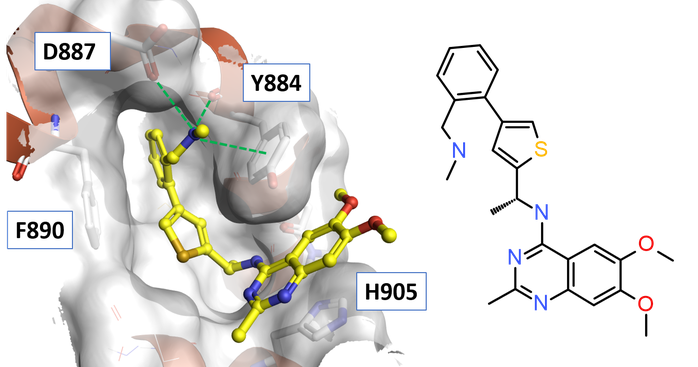
Figure 6.化合物23与SOS1结合位点的相互作用模式(PDB: 5OVI)
进一步的筛选和抗增殖数据证明化合物23(BAY-293)是靶向KRAS-SOS1相互作用有效、选择性的抑制剂,并且表明抑制GEF可能代表着靶向RAS驱动的肿瘤治疗可行方法。
结论
拜耳的这篇论文展示了Spark方法的实用性。 除了作为一个极好的生物电子等排体基团替换之外,Spark的先进功能还包括易于使用的水分子替换方法、分子大环化、分子生长和分子连接。在拜尔的这个研究中,Spark建议了如何将占据蛋白结合位点不同部分的两个不同分子连接起来,并将SAR从一个系列转移到另一个系列,SPARK在其中起了至关重要的作用。
