编译:肖高铿
日期:2019/09/30
原文:Wang, Y., Fu, Q., Zhou, Y., Du, Y., & Huang, N. (2019). Replacement of Protein Binding-Site Waters Contributes to Favorable Halogen Bond Interactions. Journal of Chemical Information and Modeling, 59(7), 3136–3143. https://doi.org/10.1021/acs.jcim.9b00128
摘要
在基于结构的药物设计领域中,蛋白质电负性原子与配体卤素原子之间的卤键相互作用日益受到关注。然而,理解上的空白需要我们更好地研究那些主导有利卤键相互作用形成的力的作用,并且开发有效且高效的计算方法以便在先导化合物优化过程中“设计”有利的卤键相互作用。在此,我们分析了配体卤原子和蛋白主链羰基之间的特征性卤键相互作用的晶体结构的结合位点水性质,发现参与卤键相互作用的卤原子在配体结合后经常替换计算出的结合位点的水。此外,我们观察到卤键相互作用的优势方向与这些被取代的水的取向很好地吻合,被卤素替换后形成与不形成卤键相互作用的水表现出不同的能量特性。我们发现替换计算的结合位点水有助于形成有利的卤键相互作用,这为利用卤键与蛋白主链羰基的相互作用的合理药物设计提供了实用的方法。
前言
卤键(Halogen bond,XB)是一种高度定向、特异性的非共价相互作用,在共价键合的卤素原子(C-X,X=Cl、Br、I;XB Donor)与亲核试剂(Nu; XB acceptor)之间形成。由于卤原子电荷分布的各向异性使得C-X键卤素末端形成带正电荷的静电区,称为σ-空穴(σ-hole),与带负电荷的静电亲核试剂良好地相互作用。C-X··Nu角接近180,最有利的相互作用能来自几乎线性的”迎面”方向。在过去十年中,PDB中晶体结构的系统分析已经揭示卤代配体和靶蛋白之间的XB相互作用是许多双分子相互作用的基础。计算化学研究包括复合物结构的QM / MM计算和模型系统的QM计算,已证明XB相互作用在蛋白质-配体结合中的特定作用。特别值得注意的是,结合额外点电荷(extra point of charge)分子力场的发展已使蛋白质-配体相互作用中XB相互作用的分子力学研究成为可能。然而,在药物化学领域,通常仅回顾性地认识到XB相互作用对改善靶标结合亲和力的贡献。只有极少数情况下可以合理利用XB相互作用进行先导化合物优化。特别是通过计算指导设计相互作用的情况下,基于结构的药物设计没有充分利用XB相互作用。
我们最近报道了卤代配体与5-羟色胺2B(5-HT2B)受体中Phe217的骨架羰基氧原子之间的潜在XB相互作用,并且进一步预测了已知5-HT2B配体与该受体中Phe217、Gly221和Gln359的骨架羰基氧原子之间先前未表征的XB相互作用。此外,我们早期的基于结构的发现工作,寻找新颖的5-HT2B受体拮抗剂,为有效的虚拟筛选方案的开发提供了条件,该方案包括一种基于计算的结合位点水的结构过滤器。有趣的是,我们发现对接卤代配体的XB卤原子基本上与计算出的与所涉及的骨架羰基形成氢键(HBs)的结合位点水重叠(图1)。计算的水中O-H键的取向和配体中C-X键的取向(表明XB相互作用的优先方向性)很好地对齐,这一发现表明在配体结合时XB卤素原子明显取代结合位点水。此外,在p53癌症突变体Y220C的晶体复合物结构中还证明,用XB卤素原子取代与Leu145骨架羰基相互作用的结晶水有助于改善配体的结合。
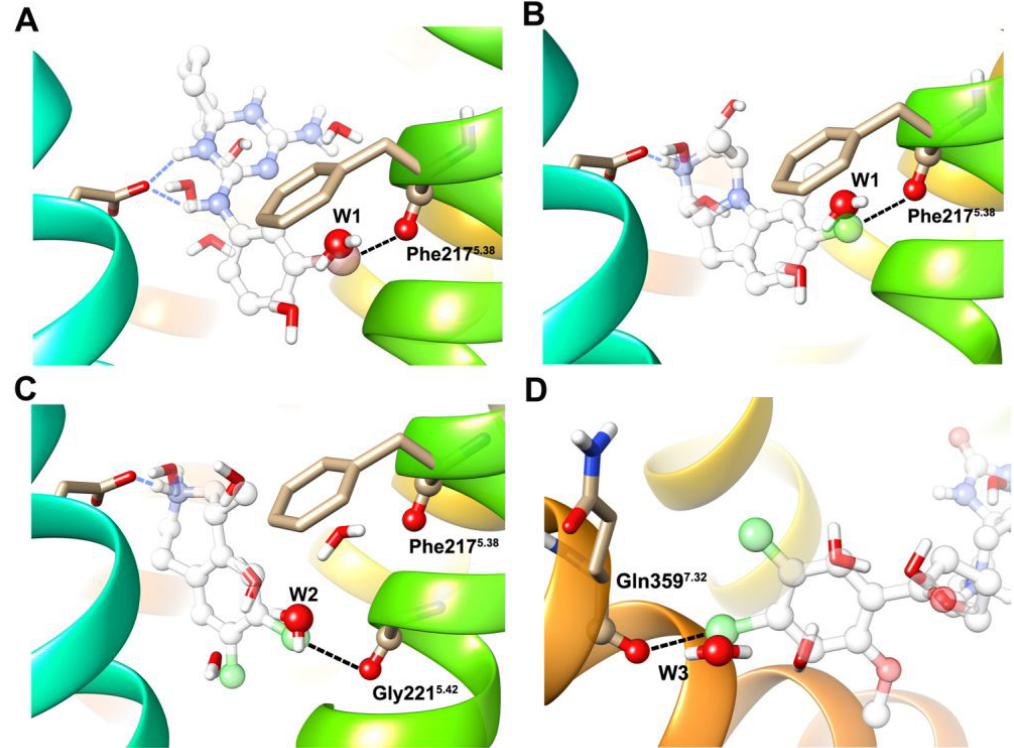
图1. 在5HT2B受体中的模拟化XB相互作用和预测的结合位点水置换。 XB用黑色虚线表示,HB用青色虚线表示,对接的配体透明显示。(A)预测拮抗剂中的溴原子形成XB相互作用,并与计算的结合位点水W1在Phe217的位点重叠。 (B)预测ChEMBL化合物(CHEMBL190699)中的氯原子形成XB相互作用,并与在Phe217处计算出的结合位点水W1重叠。(C)预测ChEMBL化合物(CHEMBL178366)中的氯原子形成XB相互作用,并在Gly221的位点与计算的结合位点水W2重叠。(D)预测ChEMBL化合物(CHEMBL91221)中的氯原子形成XB相互作用,并与Gln359位点计算的结合位点水W3重叠。
蛋白质-配体结合中的焓-熵补偿是一个复杂的热力学现象,其中结合位点水的置换通常被认为是通过释放水而获得熵,但是由于与蛋白质结合位点残基的氢键相互作用而失去焓。此外,对蛋白质表面水的大规模计算研究表明:比之与其他带电或极性基团相互作用的水,与主链羰基相互作用的计算水具有相对较高的自由能(相对弱结合)和中等熵(中度有序水)。因此,我们假设,除了众所周知的XB键相互作用的有利静电相互作用之外,在配体结合后XB卤素原子取代了与蛋白质骨架羰基相互作用的有序结合位点水,可能有助于提高结合亲和力,如熵的有利增加的结果。
在本研究中,我们收集了配体中的芳族卤原子(Cl,Br,I)与蛋白质骨架羰基氧原子之间具有确定的XB相互作用的晶体结构。然后我们使用溶剂性质分析(SPA)程序计算了在配体未结合状态下蛋白质结合位点水的分布和能量性质。我们发现在大多数XB情况下,XB卤素原子取代了计算的结合位点水,并且这些水的取向被XB卤素原子取代,反映了XB相互作用的优先方向性。此外,与被卤素原子取代后不形成XB相互作用的水相比,被XB卤素原子取代的计算水具有不同的能量性质。因此,除了揭示XB相互作用在蛋白质-配体结合中的作用的基本见解之外,我们的研究提供了如何将结合位点水置换策略纳入利用XB相互作用进行合理药物设计的计算指导。
材料与方法
数据集(Data set collection)
本研究探索了蛋白质数据库(PDB)(2018年9月),我们排除了未归类为小分子配体的部分,例如无机卤离子和卤素修饰的氨基酸。 脂肪族卤素配体也由于其XB能力差而被排除在外。 XB数据集包括在较重的芳族卤原子(Cl,Br,I)和主链羰基氧原子(CX···O = C)之间具有XB相互作用的PDB晶体结构。 在本研究中,将XB的距离标准定义为相应的范德华(vdW)半径之和作为XB的最大距离,其中X··O距离d1短于相应vdW的总和半径(Cl··O为3.27Å,Br··O为3.37Å,I··O为3.50Å)。 C-X··O角θ1表示σ-hole的可及范围,定义为大于120°;定义X···O=C角θ2大于80°(图2A)。
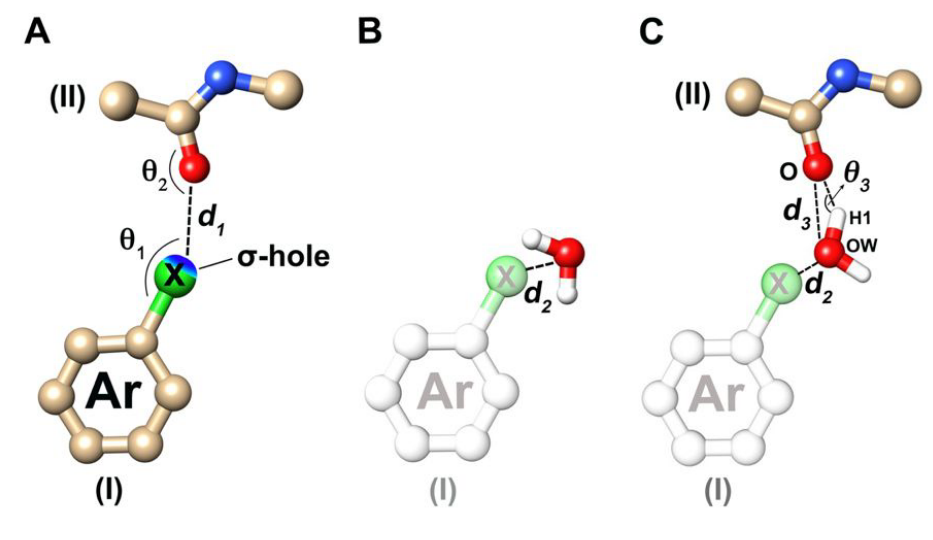
图2. XB数据集收集标准以及置换或替换计算出的结合位点水的示意图。X = Cl,Br,I;(I)芳族卤代配体;(II)蛋白质主链羰基。(A)用于对XB相互作用进行分类的标准:d1 小于∑rvdW ,θ1大于120°,θ2大于80°。(B)结合位点水的置换图,d2小于1.5Å。(C)替换结合位点水的示意图,d2小于1.5Å,d3小于4.0Å,θ3大于100°的。
非XB数据集代表了不可能有芳香族卤原子与蛋白质形成XB相互作用的一类晶体结构。 数据集排除了在芳族卤原子4.0Å内的任何HB供体原子(可能的XB受体)和HB受体原子(也为XB受体)。 允许在芳族卤原子4.0Å以内的非极性原子存在。 用ChemScore对芳香族卤素原子与蛋白质的相互作用打分,过滤掉低于20分的结构以减少命中的晶体结构。
结合位点水的性质分析
利用各种物理模型和采样方法的不同计算工具已被开发出来用于预测蛋白质结合位点水分子,各种方法汇总于表S3中。SPA程序通过利用结合位点水分子来计算结合位点水分子的能量特性。利用分子动力学/非均匀流体溶剂化理论(MD / IFST)方法,SPA程序可以用来计算结合位点水分子的能量性质。
简而言之,在蛋白质结合位点里水的性质是通过在显性水中的未结合配体结构的MD模拟获得的。所有的MD模拟均通过GROMACS程序(2018.3版)在GPU上用AMBER99SB力场对蛋白质和TIP3P水模型进行计算。截去距配体25Å之外的蛋白质残基,以减少模拟系统的大小。
结合位点水的卤原子置换与替换
如果聚集的水氧原子位于配体中XB或非XB卤素原子的1.5Å(d2)以内,则认为计算出的结合位点水被卤素原子置换了(图2B)。 在XB数据集中,如果置换的水与所涉及的主链羰基形成HB相互作用,则认为水被卤素原子取代。 HB相互作用的标准要求水氧原子与羰基氧(d3)之间的距离小于4; 角O-H1-OW,θ3,大于100°(O是羰基的氧; H1是与羰基相互作用的氢; OW是水的氧原子)(图2C)。
结果与讨论
蛋白质结合位点水性质的分析表明,配体结合后XB卤素原子取代了结合位点水
在XB数据集中,我们根据芳族卤原子与蛋白质骨架羰基之间XB相互作用的定义标准从PDB收集了347个晶体结构(XB数据集的PDB ID见Table S1)。将XB复合物结构(包括CX键和N-甲基乙酰胺)按公共的酰胺基团进行叠合,确定了CX键相对于酰胺基团的总体空间分布(图3A)。 这些分布在很大程度上与基于QM计算的卤代苯···骨架复合物的球形扫描所获得的分布一致。 为了便于比较,我们还收集了非XB数据集中的817个晶体结构(非XB数据集的PDB ID见Table S2)。
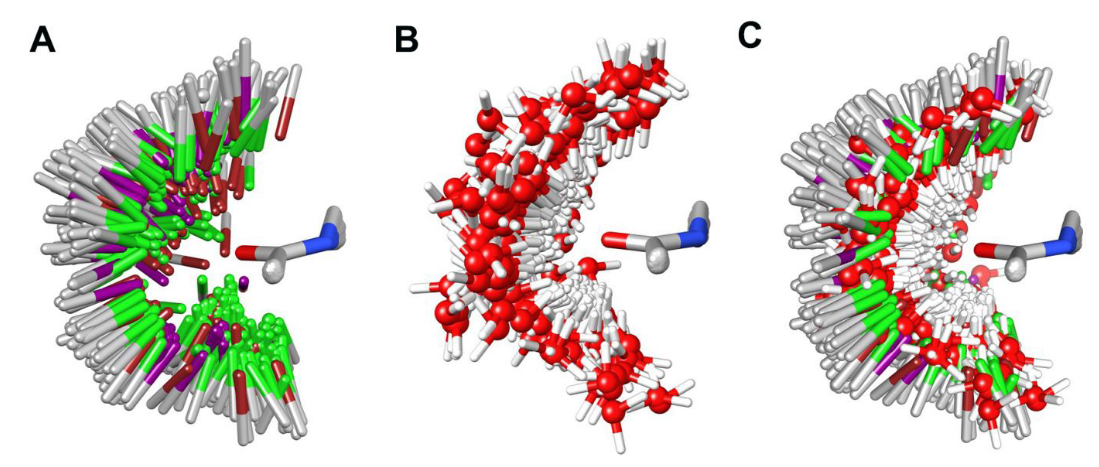
Figure 3. 基于公共的酰胺基团叠合后,XB模型系以及被XB卤素原子取代的计算结合位点水的总体分布。(A)C-X键的分布;(B)被XB卤原子取代的计算结合位点水的分布; (C)C-X键和被XB卤原子取代的计算结合位点水的组合分布。
我们对XB和非XB晶体结构进行SPA计算以分析结合位点水的性质。在XB数据集中,我们发现91%(316个)晶体结构具有XB卤素原子以置换计算的水(见表1)。在这种情况下,如果配体不止一个XB卤素原子,则相应数目的结合位点水被置换或置换。相反,在非XB数据集中仅55%(447个)晶体结构具有取代水的卤素原子 (见表1)。在改变水置换的距离截断值(d2)时,XB卤素的水置换百分比总是高于非XB卤素的水置换百分比(图4A),这表明在蛋白质结合位点中,XB位点比非XB位点更倾向于聚集有序的水。
Table 1. 两个数据集中卤素原子替换或替换计算的结合位点水的百分比差异
| Data Set | 被卤原子置换(Displace)水的百分比 | 被卤原子替换(Replace)水的百分比 |
|---|---|---|
| XB | 91 | 82 |
| non-XB | 55 | Not applicable |
此外,在总XB数据集的82%中,XB卤原子替换了与主链羰基形成HB的水(Table 1,图3B)。 修改簇状水和羰基之间的HB距离截止值(d3),我们发现XB卤素取代水的百分比随着d3从3Å增加到4Å而增加,并保持恒定超过4.0Å(图4B)。 以上结果表明,除了有利的XB相互作用之外,配体与蛋白质靶标的整体结合亲和力可能源于释放有序水而来的熵增贡献。

Figure 4. 修改d2或d3临界值后,卤原子水置换或置换的百分比变化。(A)修改d2距离截止值后XB卤素和非XB卤素置换水的百分比。(B)改变d3距离截止值(d2 = 1.5Å)后,XB卤素替换水的百分比变化。
XB卤素原子替代水的方向反映了XB相互作用的优先方向性
C-X键和被XB卤素原子取代的结合位点水的组合分布如图3C所示,其中计算水的大多数氢原子沿着C-X键的延伸分布。为了描述在XB数据集中的82%水置换中水的取向与XB相互作用的优先方向性之间的关系,我们分析了芳族骨架与卤素原子的共价键的矢量以及水的氧(OW)、氢(H1)与主链羰基相互作用的键的矢量之间的角度θ4。发现角度分布集中在10 ° 和30 ° 之间(图5),这两个矢量叠合后几乎平行。这些数据表明水的OH可以通过具有 σ-孔(σ-hole)特征的配体卤素原子来模拟。这些角度分布还表明,在某种程度上,计算出的结合部位水反映了XB相互作用的优先方向性。此外,相对于XB相互作用的优先方向性,这些取代水的取向为利用XB相互作用进行合理药物设计提供了基础。
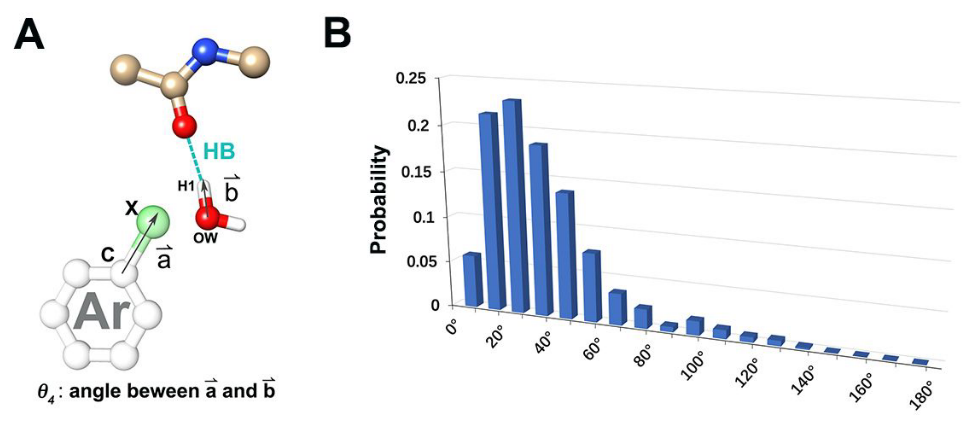
Figure 5. XB数据集中卤原子取代计算水的取向分布。 (a)角度θ4图;(b)在XB数据集中用卤素原子取代计算结合部位水的系统中角度θ4的直方图。
XB卤原子取代水的微分能量性质
定性地理解水在蛋白质-配体结合过程中的作用可以为药物发现和设计提供策略。在本工作中,我们表征了被XB卤素原子取代或被非XB卤素原子取代的水的能量性质(水的详细能量性质在支持信息,Table S4和S5)。表2总结了计算得到的被XB卤原子取代的水的能量学特征,平均取代自由能(ΔG)、焓(ΔH)、熵(-TΔS)和占有值分别为-1.68、-18.25和1.26kcal/mol和0.87。与非XB卤素原子置换的水相比,它们的平均置换自由能(ΔG)、焓(ΔH)、熵(-TΔS)和占有值分别为-0.38、-16.94和0.84kcal/mol和0.77(表2)。因此,平均而言,被XB卤素原子取代的水比被非XB卤素原子取代的水更稳定(ΔG更低)、更有利(Δ更低)、更不灵活(-TΔS和占有率更高)。
Table 2.被卤键与非卤键卤原子替换的计算结合水平均能量性质
| Data Set | ΔG(kcal/mol) | ΔH(kcal/mol) | -TΔS(kcal/mol) | Occupancy |
|---|---|---|---|---|
| XB | -1.68 | -18.25 | 1.26 | 0.87 |
| non-XB | -0.38 | -16.94 | 0.84 | 0.77 |
焓通过目标水和系统其余部分之间的相互作用能来估计。被XB卤原子取代的水更有利(Δ H较低),这可以解释为极性骨架羰基的存在与周围水形成了更有利的相互作用,这一结果与蛋白质表面水的大规模结构和能量特性一致。关于熵项,我们的结果表明,被XB卤原子取代的水比被非XB卤原子取代的水平均具有显著更大的正熵值,这是高度空间定域(the high degree of spatial localization)的结果。此外,被XB卤素原子取代的水的占用率高于被非XB卤素原子取代的水的占用率,这表明被XB卤素原子取代的水更加的空间定域化,每个水合簇具有更大的水含量。
通过重新检查XB案例进行验证
用蛋白质-配体相互作用中众所周知的XB案例来验证我们的研究。由于在铰链区中存在两个与蛋白骨架羰基相互作用的XB,四卤代苯并咪唑CK2抑制剂是研究蛋白质-配体相互作用中XB相互作用的理想靶点。结合位点水性质分析表明,XB卤素原子替换了沿铰链区的两个水(图6A)。4,5,6,7-四溴苯并三唑与CDK2也具有相同的结合模式,其中两个溴原子替换了沿着铰链区的两个结合位点水(图S1A)。在CDK9的结合位点也发现了类似的情况,其中两个铰链区水被DRB 的两个氯原子替换,在铰链区中形成两个XB与主链羰基相互作用(Figure S1B)。这两个XB相互作用形成了对CDK9选择性的分子基础。除了与铰链区形成HB的水外,与门区形成HB的水(由KLIFS定义)也被XB卤素原子替换,如与T790M表皮生长因子受体(EGFR)激酶结合的Dacomitinib中的氯原子(图6B)。天然存在的XB供体的例子是来自甲状腺的甲状腺素类激素,其中甲状腺激素与其受体的结合是由XB相互作用介导的。SPA结果显示,三碘甲状腺素(T3)中的两个XB碘原子取代了两个结合位点的水(图6C)。此外,3,5,3 ′,5 ′-四碘-L-甲状腺素(也称为甲状腺素或T4)通过与骨架羰基形成XB相互作用而与Trnsthyretin结合,SPA结果也证实了我们的发现(Figure S1E)。
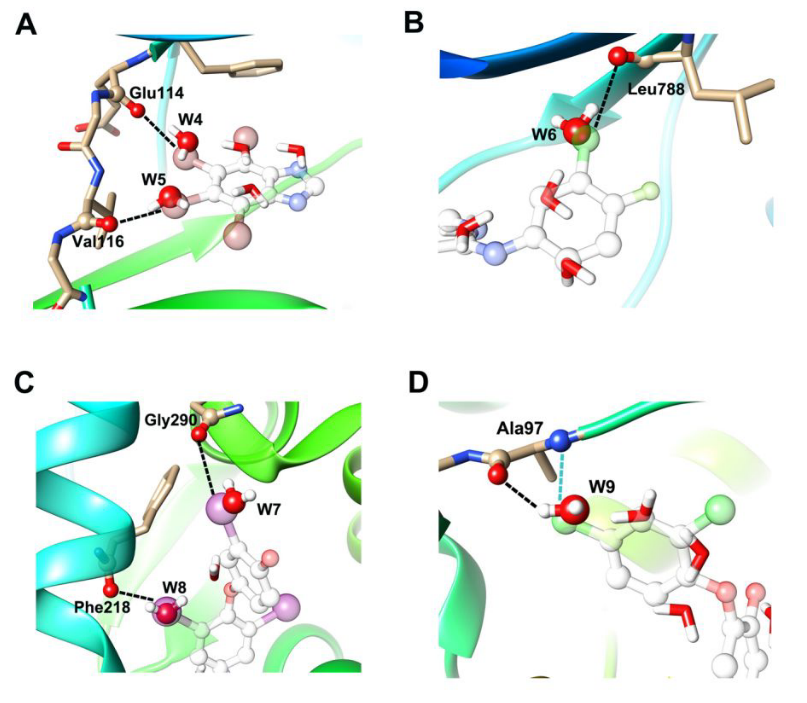
Figure 6. XB卤素原子替换计算的结合位点水算例。(A)CK2抑制剂中的两个溴原子取代了CK2中的水W4和W5,PDB ID 2oxy。(B)Dacomitinib中的氯原子替换了T790M EGFR激酶中的水分子W6,PDB ID 4i24。(C)T3中的两个碘原子替换了甲状腺激素受体PDB ID 2h79中的水W7和W8。(D)三氯生中的XB和HB氯原子取代了ENR中的水W9,PDB ID 2qio。
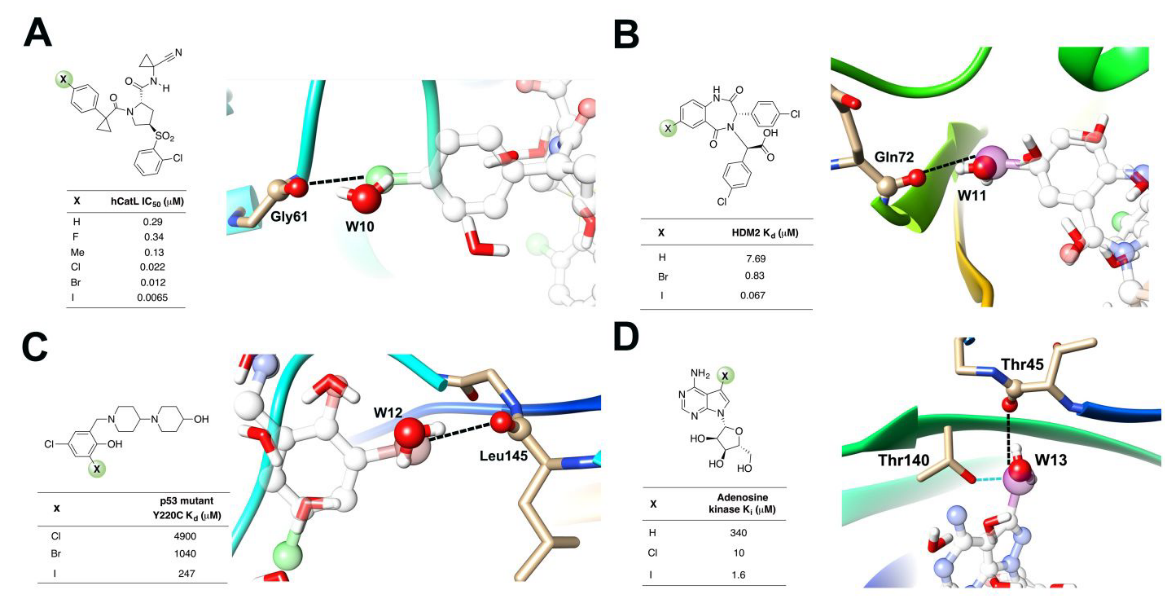
Figure 7. 用XB来研究SAR的算例,其中XB卤原子替换了计算出的结合位点水。(A)hCatL抑制剂中的氯原子替换了水分子W10,PDB ID 2xu1。(B)MDM2拮抗剂中的碘原子替换了水分子W11,PDB ID 1t4e。(C)p53突变体Y220C抑制剂中的溴原子替换了水分子W12,PDB ID 5aba。(D)AK抑制剂Iodotubercidin中的XB与HB碘原子替换了水分子W13,PDB ID 1lij。
我们还从XB数据集中SAR来验证我们的研究。对蛋白质-配体相互作用中XB相互作用的一项系统研究涉及人组织蛋白酶L(hCatL)抑制剂,如图7A所示。在将取代基从H改变为Cl、Br或I原子时观察到亲和力的增加,卤素替换了与主链羰基形成HB的水。此外,相似的情况也发生在小鼠MDM2(图7B)和p53-Y220C突变体(图7C)的肿瘤抑制剂中。Iodotubercidin的碘原子与与AK中主链THR45的羰基形成XB相互作用、与THR140的侧链羟基形成HB相互作用,并替换了结合位点中的水分子(图7D)。在支持信息中可以找到更多的SAR研究支持XB的算例,其中XB卤素原子替换了结合位点水分子(Figure S2)。
结论

通过替换计算出的结合位点水分子,提出利用XB相互作用进行合理药物设计的策略
Figure 8. 通过替换计算出的结合位点水分子,提出利用XB相互作用进行合理药物设计的策略
替换蛋白质结合位点的水已成为药物设计中提高先导化合物结合亲和力的策略之一。合亲和力提高的有益贡献来自于(1)将有序水释放到本体溶剂中相关的熵增;和(2)形成蛋白质-配体相互作用的焓增加。在我们的研究中,当XB卤原子与蛋白质主链羰基结合时伴随着与羰基发生氢键作用的结合位点水被替换,这些水具有反映XB相互作用的优先方向性的独特空间取向。
我们的研究为理性药物设计提供了实用的策略:用XB卤原子替换与骨架羰基发生氢键相互作用的水,与骨架羰基形成XB相互作用,并且取向与羟基水WAT氢键相互作用的取向相似。此外,要确保C-X键和O-H键之间处于最佳角度(160-180°),还要确保卤原子和水的氧原子之间的距离小于1.5Å,这对替换结合位点水分子提供有利的熵增也是至关重要的。这些考虑可提高母体化合物的结合亲和力。
总之,通过分析引入XB与主链羰基相互作用的蛋白质结合位点的水性质,我们的研究表明XB卤素原子在配体结合后替换了结合位点水,具有与释放有序水有关的熵的潜在有利增加。 这些发现为了解XB相互作用在蛋白质-配体相互作用中的作用提供了更深刻的见解。 此外,研究表明,被XB卤原子取代的水的方向反映了XB相互作用的优先方向性。 与被非XB卤素原子取代的水相比,被XB卤素原子取代的水的能量性质具有不同的特性。 此外,一些著名的XB示例验证了我们的研究。 最后,我们提出了一种合理的药物设计实用策略,利用XB相互作用来代替计算出的结合位点水。
